In diesem Artikel beschäftigen wir uns mit dem Säuregrad (pH-Wert) und in welcher Weise er das Wachstum von Pflanzen beeinflusst. Dabei setzen wir uns zunächst mit den Begriffen "Säuregrad" und "pH-Wert" näher auseinander.
Der Säuregrad
Der Säuregrad ist von grundlegender Bedeutung für das Leben auf der Erde. Er bestimmt die Eigenschaften, Qualität, Absorption und Löslichkeit vieler Substanzen. So verrichten zum Beispiel Enzyme, die für fast alle biologischen Prozesse in Organismen verantwortlich sind, ihre Arbeit nur im richtigen Säurebereich[1]. Bereits geringfügige Schwankungen im Säuregrad des Blutes sind tödlich.
Was ist der pH-Wert?
Der pH-Wert (pontentiahydrogenii) bezeichnet den Säuregrad oder die Alkalinität einer Lösung[2]. Die pH-Skala reicht von 0 bis 14, wobei eine Lösung mit einem pH-Wert zwischen 0 und 7 sauer und eine Lösung zwischen 7 und 14 alkalisch ist. Essig und Coca-Cola weisen einen pH-Wert unter 3 auf, Soda und Seife einen pH-Wert über 8. Ein pH-Wert von 7 ist neutral. Reines Wasser hat bei Raumtemperatur einen pH-Wert von 7. Leitungswasser enthält Kalzium und hat deswegen in der Regel einen etwas höheren pH-Wert.
Viele natürliche Milieus, wie die menschliche Haut, Substrate und Nährmedien, sind leicht sauer und weisen einen pH-Wert zwischen 5,0 und 6,5 auf. Bei Nahrungsmitteln bevorzugen die meisten von uns leicht saure oder neutrale Substanzen wie z. B. Wasser. Auch Pflanzen bevorzugen leicht saure Substanzen. In der Natur ist ein pH-Wert um 5,5 so weit verbreitet, dass er von manchen Botanikern als „neutral“ angesehen wird.
Warum ist der Säuregrad so wichtig?
Der Säuregrad hat einen wesentlichen Einfluss auf die Absorption und Löslichkeit bestimmter Nährstoffe (siehe Grafik 1).
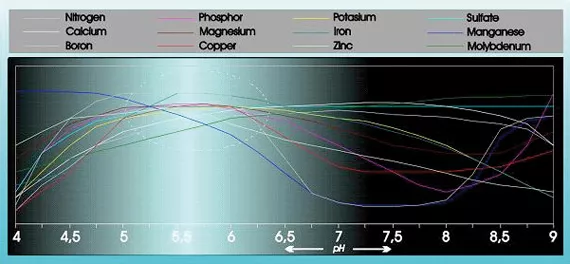
Zudem ist er von entscheidender Bedeutung für die Struktur, den Zerfall organischer Substanzen und das Mikroleben im Boden und beeinflusst er die Ausschwemmung von Nährstoffen, Schwermetallen und Pestiziden aus dem Boden.
Ein pH-Wert, der zu niedrig oder zu hoch ist, kann sich nachteilig auf das Wachstum Ihrer Pflanzen auswirken. Darum ist es wichtig, auf den richtigen Säuregrad zu achten. Aber wie stellen Sie fest, ob der pH-Wert aus dem Lot ist? Ganz einfach: durch Erfahrung! Um Ihnen zu helfen, haben wir einige der Symptome, die auftreten können, hier für Sie aufgelistet:
Symptome bei einem zu niedrigen pH-Wert (Substrat ist zu sauer):
- Bestimmte Nährstoffe lassen sich leichter lösen, was zu einem Überschuss an Mangan, Aluminium und Eisen führen kann.
- Eine beschleunigte Ausspülung kann zu einem Mangel an Phosphor, Kalium, Magnesium und Molybdän führen.
- Magnesiummangel, vor allem bei Freilanderde.
- Der Boden ist generell nährstoffarm.
- Das Bodenleben ist beeinträchtigt.
Symptome bei einem zu hohen pH-Wert (Substrat ist zu alkalisch):
- Die meisten Nährstoffe lassen sich schwer lösen, wodurch es zur Ausfällung von Kalzium, Eisen und Phosphatverbindungen kommt.
- Eine verminderte Absorption, vor allem von Mangan, Phosphat und Eisen, aber auch von Kupfer, Zink und Bor. Dies führt zu Mangelerscheinungen, besonders bei feuchten und kalten Anbaumedien.
- Eine beschleunigte Zersetzung von organischem Material in sandigen Böden.
Wovon hängt der pH-Wert ab?
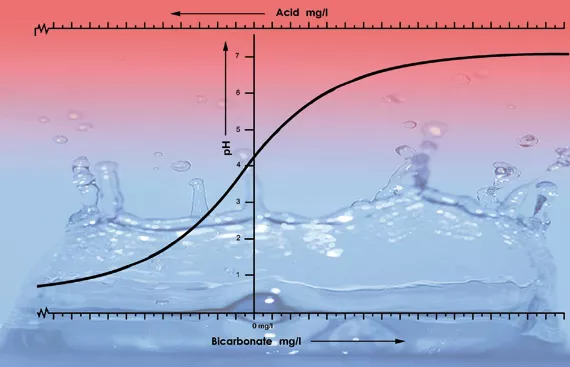
Einer der Schlüsselfaktoren, die den pH-Wert in einer Lösung oder im Substrat bestimmen, ist die Pufferkapazität. Mit Pufferkapazität wird eine Art Gleichgewicht bezeichnet, das sich ständig selbst wiederherstellt. Fügt man einem Liter Leitungswasser mit einem pH-Wert von 7 einen Tropfen Säure hinzu, so beeinflusst das den Säuregrad kaum. Versetzt man jedoch einen Liter destilliertes Wasser (Batteriewasser) mit einem Tropfen Säure, so sinkt der pH-Wert schlagartig. Dies liegt daran, dass Leitungswasser Bikarbonat enthält und destilliertes Wasser nicht. Bikarbonat ist die wichtigste Puffersubstanz für pH-Werte zwischen 5,5 und 7,5 in Wasser[4].
Das Bikarbonat verbindet sich in der Lösung mit der Säure, wobei Kohlendioxid an die Luft abgegeben wird. So wird die Säure neutralisiert, und die Schwankungen des Säuregrads bleiben gering, solange Bikarbonat vorhanden ist.
Bei einem pH-Wert von 5,3 ist das gesamte Bikarbonat gebunden und keine Puffersubstanz mehr vorhanden. Der pH-Wert wird instabil und sinkt sofort ab, wenn mehr Säure zugegeben wird (siehe Grafik 1). Die für den gewünschten Säuregrad einer Nährstofflösung erforderliche Säuremenge lässt sich daher anhand des Bikarbonatgehalts berechnen. Der Bikarbonatgehalt von Leitungswasser wird von den Wasserversorgungsunternehmen in der Regel in Milligramm pro Liter angegeben[5].
Die Pufferkapazität und der Säuregrad des Substrats hängen von dessen Zusammensetzung und Frische ab. Der pH-Wert wird im Allgemeinen durch die Anwesenheit von organischem Material, Kalzium und Bikarbonat bestimmt. Ton enthält immer Kalziumkarbonat und weist deshalb einen verhältnismäßig hohen pH-Wert auf, der schwer zu beeinflussen ist, während Torf- und Sandböden sauer sind[6].
Die Pflanzen selbst haben ebenfalls großen Einfluss auf den Säuregrad. Je nach dem Entwicklungsstadium der Pflanze, der jeweiligen Düngergabe, den vorhandenen Nährstoffen, den Temperaturschwankungen im Wurzelbereich und der Lichtintensität scheiden die Wurzeln entweder saure oder alkalische Substanzen aus. Das erklärt auch, warum der pH-Wert im Wurzelbereich ständigen Schwankungen unterliegt. Durch die Zufuhr einer speziell angepassten Nährlösung kann der pH-Wert in den verschiedenen Entwicklungsstadien der Pflanze so stabil wie möglich gehalten werden.
Auch das Mikroleben, die CO2-Konzentrationen und das Algenwachstum können den Säuregrad im Wurzelbereich und im Nährstoffbehälter beeinflussen[7].
Wie kann man den pH-Wert messen?
Der pH-Wert kann ganz leicht mit Hilfe eines pH-Indikators, wie Lackmuspapier oder einem pH-Teststreifen, gemessen werden. Diese sind relativ billig, aber nicht immer sehr genau: Mitunter können Abweichungen von 1 bis 2 pH-Einheiten auftreten. Digitale pH-Messgeräte sind im Allgemeinen teurer und ihre Genauigkeit hängt vom Gerätetyp und von ihrer regelmäßigen Kalibrierung mit Eichflüssigkeit ab.
Probennahme

Der pH-Wert des zur Bewässerung der Pflanzen verwendeten Wassers ist durchaus wichtig. Noch wichtiger ist jedoch der Säuregrad in der Wurzelumgebung. Eine korrekte Probenahme ist daher grundlegende Voraussetzung für eine verlässliche Messung des pH-Wertes. Die Probe muss repräsentativ für den durchschnittlichen Säuregrad im Wurzelbereich sein.
In rezirkulierenden Systemen wird die Messung des pH-Wertes ganz einfach in der umlaufenden Nährlösung vorgenommen.
In Substraten ohne Rezirkulation wird die Nährstofflösung an verschiedenen Stellen des Substrats (Steinwolle, Agrofoam) entnommen. Wo genau Proben entnommen werden sollen, darüber streiten sich die Experten seit Jahr und Tag. In Anlehnung an die Vorgehensweise renommierter Labors empfehlen wir, die Proben im Bereich der Wurzeln zu entnehmen, d. h. unterhalb und in der Nähe der Tropfdüsen. Entnehmen Sie kleine Proben an möglichst vielen Stellen und immer zur gleichen Uhrzeit, vorzugsweise nach der zweiten Tropfdosierung während der Tagesphase des Lichtzyklus.

Erfolgt der Anbau in Erde, Kokos- oder Torfsubstrat, dann sollte an verschiedenen Stellen ein wenig Material entnommen werden.
Das zuverlässigste Verfahren zur Bestimmung des Säuregehalts Ihrer Probe ist die 1:1,5-Extraktionsmethode. Dazu befeuchten Sie ganz einfach das Anbaumedium, bis das Wasser über Ihre Finger tropft, wenn sie es kneten und fest zusammenpressen. Nehmen Sie einen 250-ml-Messbecher und füllen Sie ihn bis zur 150 ml-Markierung mit demineralisiertem Wasser. Geben Sie nun so viel Anbaumedium bei, bis die 250 ml-Markierung erreicht wird (Foto 3). Rühren das Ganze gut um und lassen Sie es ein paar Stunden lang stehen. Filtern Sie danach das Anbaumedium heraus und führen Sie die Messung durch.
Der richtige pH-Wert für jedes Wachstumsmedium
Beim Anbau auf Substrat sollte der pH-Wert im Wurzelbereich zwischen 5,0 und 6,4 liegen. Geringfügige Abweichungen nach oben oder unten haben keine direkten schädlichen Folgen. Diese zeigen sich erst bei Werten unter 4 und über 8. Bei pH-Werten unter 4 treten sofort Wurzelschäden auf. Außerdem werden Schwermetalle, wie Mangan oder Eisen, so gut aufgenommen, dass sie zu einer Vergiftung der Pflanzen (Nekrosen) führen können. Werte zwischen 7 und 8 sind für die Pflanzen nicht unmittelbar schädlich. Allerdings sind Nährstoffe wie Eisen, Phosphat und Mangan unter diesen Bedingungen viel schwieriger zu assimilieren, was mit der Zeit zu Mangelerscheinungen (Chlorose und Entwicklungsstörungen) führt.

Wie kann man den pH-Wert korrigieren?
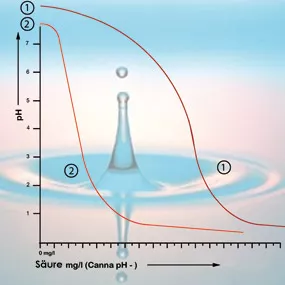
Solange sich der Säuregrad in der Wurzelumgebung zwischen 5 und 6,4 bewegt, ist es nicht notwendig, korrigierend einzugreifen. Korrigieren Sie den pH-Wert so selten wie möglich! Zu häufige Korrekturen schaden mehr als sie nützen, denn die Pflanzen benötigen Ruhe. Wichtig ist die langfristige Entwicklung des Säuregrads. Wenn der pH-Wert unter 5 sinkt oder über 6,4 ansteigt, empfiehlt es sich, den pH-Wert schrittweise anzupassen (Grafik 2).
Die einfachste Methode, den Säuregrad zu korrigieren, besteht darin, den pH-Wert der Nährstofflösung mit Salpetersäure (während der Wachstumsphase) oder Phosphorsäure (während der Blütephase) zu reduzieren oder mit Kalilauge, Kaliumbikarbonat, Soda[8] oder CANNA RHIZOTONIC zu erhöhen. Sorgen Sie dafür, dass der pH-Wert der Lösung möglichst nicht unter 5 sinkt. Beim Anbau auf Steinwolle führen niedrige Werte zu einer Beschädigung der mineralischen Fasern, wodurch beträchtliche Mengen an alkalischem Material freigesetzt werden. Außerdem ist der pH-Wert durch das Fehlen von Bikarbonat wesentlich schwieriger zu kontrollieren.
Ein hoher pH-Wert im Wurzelbereich kann auch von einer Anhäufung von Bikarbonat herrühren. Beseitigen Sie überschüssiges Bikarbonat, indem Sie einen Drain von 20 % beibehalten oder das Substrat mit einer angesäuerten Lösung spülen.
Es kann sich als sehr praktisch erweisen, die gemessenen pH-Werte zu notieren, und zwar sowohl die Werte der beigegebenen Lösung als auch die der Nährstofflösung im Substrat. So können Sie die Entwicklung des pH-Wertes und den Effekt der getroffenen Maßnahmen gut beobachten.
- Protein spaltende Enzyme benötigen ein saures Milieu (Magensaft), Kohlenhydrat spaltende Enzyme ein alkalisches Milieu (Speichel).
- Der Säuregrad einer Lösung wird durch das Mengenverhältnis von Wasserstoffionen (=sauer) und Hydroxidionen (=alkalisch) bestimmt.
- Mangelerscheinungen können auftreten, wenn die Pflanze Protonen abgeben muss, um diese Moleküle aufnehmen zu können. Ein Wachstumsmedium mit einem niedrigen pH-Wert enthält bereits große Mengen an Protonen. Diese Elemente werden ebenfalls ausgespült, da die Protonen die Moleküle von den Bindungsstellen im Substrat verdrängen.
- Bikarbonat ist jene Substanz, die für Kalkablagerungen verantwortlich ist. In Verbindung mit Natrium wird Bikarbonat unter anderem in der Medizin zur Neutralisierung von überschüssiger Magensäure eingesetzt (Alka-Seltzer).
- Manche Labors geben mitunter auch die Bikarbonathärte an. Bei der Umrechnung auf den Gehalt an Bikarbonat in mg/l muss der Wert der Bikarbonathärte mit 21,8 multipliziert werden. Beispiel: Wenn die Bikarbonathärte 11 beträgt, enthält 1 Liter Wasser (11 x 21,8=) 240 mg/l Bikarbonat.
-
Sandboden: Weideland pH 4.6 … 5.2 Bauland pH 5.0 … 5.6 Ton: Meereslehm pH 6.0 … 7.2 Flusslehm pH 6.2 … 6.4 Torf: Unverarbeitet pH 4.0 - Bei starkem Algenwachstum steigt der pH-Wert, weil der Lösung Kohlensäure entzogen wird. Bakterien können zum Beispiel bestimmte Formen von Stickstoff so umwandeln, dass sie eine versauernde Wirkung haben. Ein hoher CO²-Gehalt in der Luft führt zu mehr Kohlensäure in der Nährstofflösung (und einem niedrigeren pH-Wert) und umgekehrt.
- Soda sollte nur in kleinen Mengen verwendet werden, da es Natrium enthält, eine Substanz, die von den Pflanzen nur in sehr geringen Mengen benötigt wird und bei hohen Konzentrationen schädlich sein kann.